十年磨一剑!| 2023新版EAA/EMQN Y染色体微缺失分子诊断最佳实践指南发布
摘要:Y染色体无精子症因子(AZF)缺失检测是诊断无精子症和严重少精子症的关键技术。作为2013年EAA/EMQN指南的修订版,新版指南在回顾总结以往临床相关进展的基础上,对旧版指南内容进行了大量更新,并对EAA/EMQN提供的外部质量评估项目结果做出了反馈。基础多重PCR检测体系结合扩展性缺失分析,仍然是目前检测和正确解释AZF缺失的金标准。同时,对sY84引物序列进行了更新,且对AZFa和AZFb缺失断点的可互换边界位点也进行了改进。具体而言,新版指南不再推荐sY83和sY143被用于扩展性缺失分析,而是将sY1064和sY1192作为首选位点。尽管目前有些国家AZF缺失检测正在向注册试剂盒化过渡,但应注意的是,许多商业产品由于包含大量不必要位点而不被推荐使用。此外,目前这些可用产品都不符合用于扩展性缺失分析的新首选位点。AZFc区域gr/gr部分缺失是精子发生障碍人群特异性危险因素,也是睾丸生殖细胞肿瘤的易感因素。但这种缺失类型的检测与否仍需由诊断实验室和送检临床医生自行决定。鉴于EMQN/EAA计划运行22年的经验表明,参与计划的实验室基因型诊断错误率大幅下降,诊断报告质量也极大改善,强烈鼓励AZF检测实验室每年参与该外部质量控制计划。
Y染色体无精子症因子(azoospermia factor,AZF)缺失是导致男性不育的第二大遗传因素,其发生率仅次于克氏综合征。在普通人群中,约每4000名男性中就有1人存在Y染色体微缺失,而在不育男性中其发生率更高。不同实验室AZF微缺失发生率为2%~10%(甚至更高),主要由研究人群组成差异导致。通常,接受外部机构送检的常规诊断实验室在没有控制患者选择的情况下的发病率要低得多,通常低于2%。
已发表数据和质量控制计划都证实,不同实验室采取的检测方案差异,确实会导致不准确或完全错误的诊断,表明检测标准化和质量控制的必要性。也因此,欧洲男科学会(EAA)和分子遗传质量协作网(EMQN CIC)联合开始提供外部质量评估(EQA)计划,并定期发布Y染色体微缺失分子诊断的实验室指南。
经10年数据积累,本次EAA/EMQN关于Y染色体AZF微缺失分子诊断指南作出了大量更新,以更好服务于临床。更新要点:
01 AZFa近端边界位点sY83和sY1064不可互换,因为它们的结果取决于检测到的AZFa完全缺失近端断点的变化。重要的是,AZFa完全缺失可以与sY83(present)和sY1064(absent)兼容。因此,在强制扩展性缺失分析中只推荐sY1064,而不推荐sY83。
02 AZFb远端边界位点sY143和sY1192不能互换,只有sY1192能够区分AZFb完全和部分缺失(从而为TESE成功与否提供可靠预后)。因此,在强制扩展性缺失分析中只推荐sY1192,而不推荐sY143。
03 对sY84的正向引物和反向引物序列进行了更新,以避免正向引物错配,同时反向引物兼容亚洲人群的SNP。
04 AZFb缺失断点的可变性可导致大量AZFb和AZFbc完全缺失中sY1224近端边界位点的保留。尽管这种变异的表型尚不清楚,但建议优先使用sY121,再使用sY1224(如果sY121缺失)。
05 据目前所知,扩展性缺失分析中首选位点的变化与目前市面上任何AZF缺失分子诊断试剂盒都不完全兼容。
一、Y染色体微缺失遗传学检测的适应症
AZF缺失检测的精液评估阈值尚未达成共识。精子浓度<2×106/mL的无精症或严重少精症患者一般能够发现临床相关的缺失,而精子浓度在2~5×106/mL之间的不育患者很少有此发现。2010版《WHO人类精液检查和处理实验室手册》将生精指标改为精子总数,欧洲临床指南现今仍然将AZF缺失检测的精子总数阈值设定为<500万精子/mL;然而,在精子浓度>1×106/mL的男性中,该检测的成本效益受到质疑。但无论如何,一致建议对无精子症男性进行Y染色体缺失筛查,因为它不仅可以提供病因诊断,而且可以对TESE的成功率进行可靠估计。
图1为本指南建议的分析步骤流程图,分为基础检测体系和扩展性检测体系。常规临床参数,如激素水平、睾丸体积、精索静脉曲张、睾丸发育不良、感染等,没有任何预测价值。通常,染色体异常(46,XY/45,X核型除外)、梗阻性无精子症(除非FSH高于正常限值)或促性腺功能减退症患者不需要进行Y染色体分子分析。然而,在非特发性不育男性中已经发现了许多缺失携带者,即患有睾丸肿瘤、附睾闭塞、睾丸炎、精索静脉曲张或化疗/放疗后的患者。因此,任何伴有无精子症或严重少精症的诊断都应该是AZF检测的指征。例如,对属于上述精液类别的男性,在精索静脉曲张切除术前进行AZF筛查很重要,因为缺失携带者很可能不会从手术中受益。Klinefelter患者检测Y染色体缺失的临床实用性尚未确定。
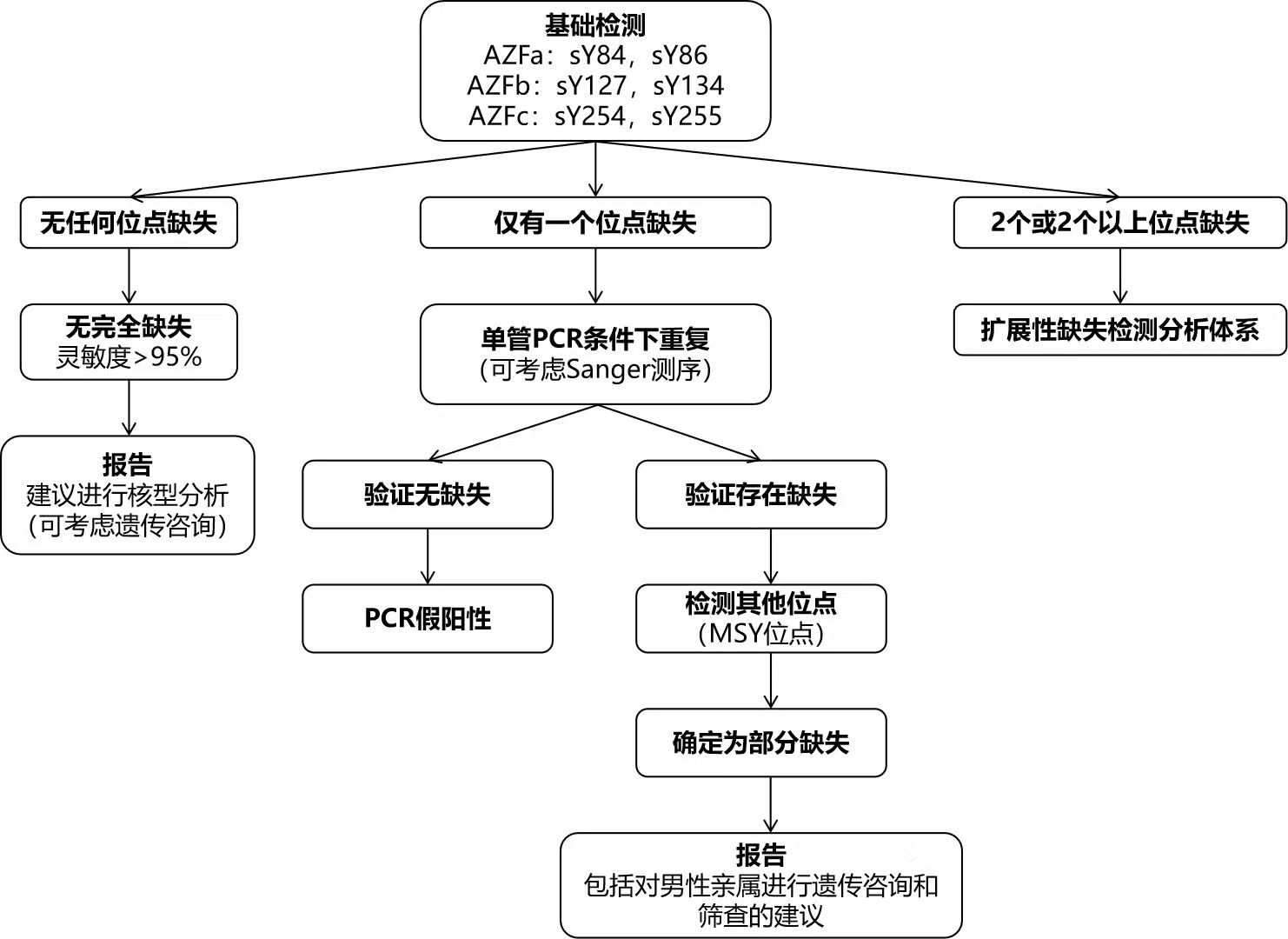
图1(A)AZF基础检测体系及诊断流程
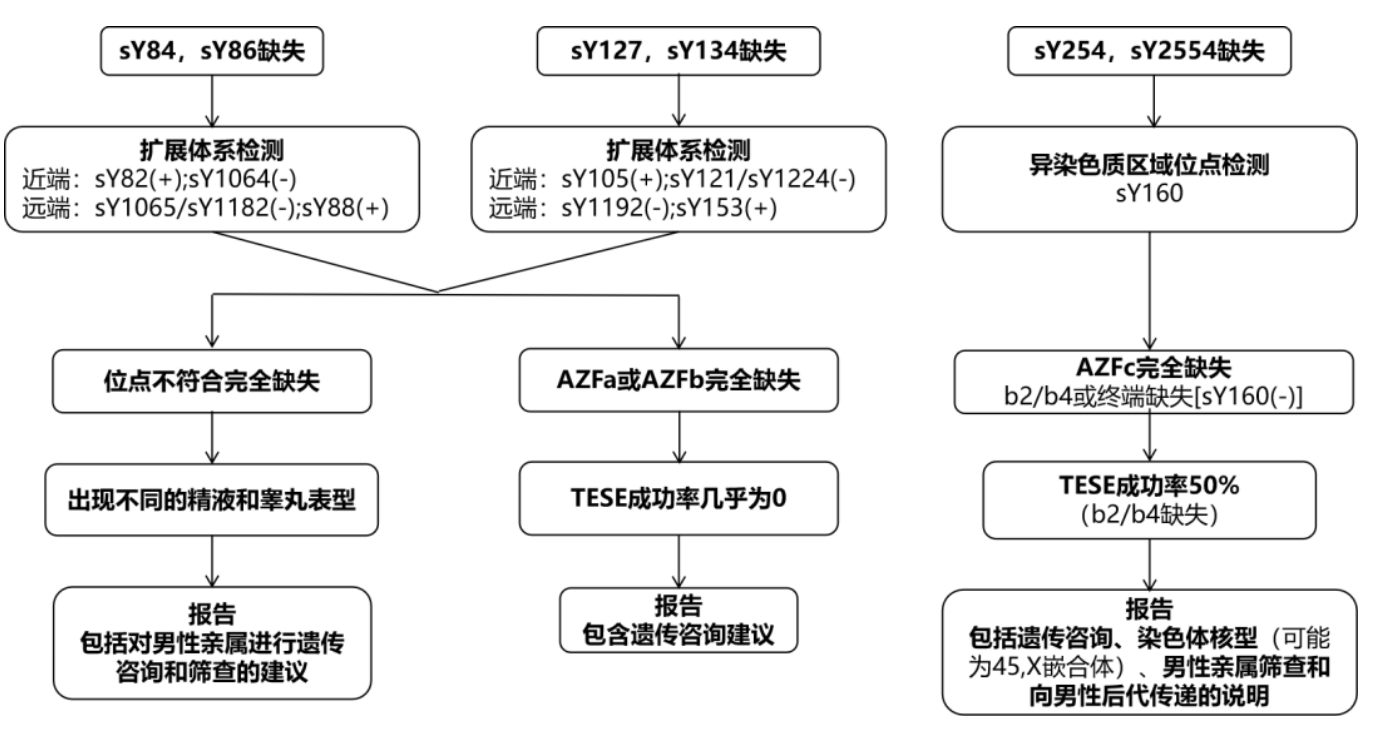
图1(B)AZF扩展性缺失检测体系及诊断流程
二、Y染色体男性特异性区域结构
Y染色体男性特异性区域(MSY)参考序列包含156个转录单位(其中包括78个蛋白质编码基因,编码27种不同的蛋白质),分为三种类型:X-退化区(X-degenerate;来自染色体祖先状态的单拷贝基因或假基因)、X-换位区(X-transposed;从X染色体获得,与相应的X区域99%同源)以及扩增区(ampliconic)。其中,后者对应于重复区,分为多个家族类型,每个重复区在家族内重复之间共享几乎完全(>99.9%)的同一性。扩增区包含9个睾丸特异性或富集表达的蛋白质编码基因家族。最初,这些家族估计至少有60个编码基因,现在这个数字已经增加到超过100个。由于扩增区的高度重复性,既可以进行基因转换,也可以进行非等位基因(染色体内)同源重组(NAHR)。扩增子可以沿着MSY以有序的方式排列,从而形成回文:在MSY的相当长范围内延伸的不同扩增子重复的镜像块。扩增子(和回文)组织增强了结构变异的产生,如缺失、重复和倒位。普遍认为,NAHR是产生AZF完全缺失的主要驱动力。这些交换发生在具有相同反向高度同源重复序列之间,导致它们之间遗传物质的丢失(以及姐妹染色单体中的相互重复)。考虑到MSY的高度重复性体系结构,已经确定了许多不同的MSY重排。只有明确确定与男性不育相关的才是本指南的重点。
三、Y染色体缺失类型及其分子机制
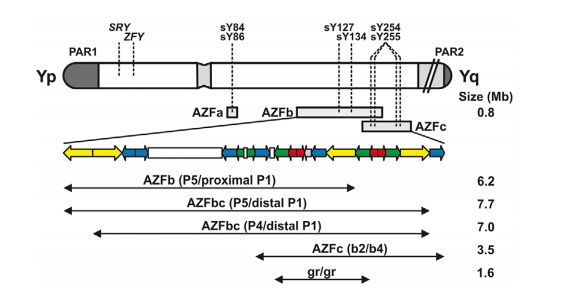
图2 Y染色体示意图和临床相关微缺失模式
本指南依旧沿用经典Y染色体微缺失区域的定义模式,分为:AZFa区缺失、AZFb区缺失、AZFbc区缺失和AZFc区缺失。
AZFa区域:长792kb,包含单拷贝基因USP9Y(原DFFRY)和DDX3Y(原DBY)。第三个基因,UTY,功能未知,定位于该区远端。AZFa完全缺失的起源可追溯到HERVyq1和HERVyq2逆转录病毒序列中同向的相同序列块之间的NAHR。重组可发生在这些逆转录病毒序列(ID1和ID2)中两个相同序列块中的一个,导致至少两种略有不同的缺失模式。无论如何,AZFa完全缺失都丢失了约792kb,包含USP9Y和DDX3Y缺失。
AZFb和AZFc这两个区域共包含24个不同的基因,其中大多数存在于多个拷贝中。AZFb完全缺失删除了6.2Mb(包括32个转录单位),并且是由P5/近端P1回文之间的NAHR引起。因此,AZFb完全缺失也可以称为P5/近端P1缺失。AZFc区包括12个基因,每个基因以可变拷贝数存在,总共32个转录单元。AZFc完全缺失去除3.5Mb(共21个转录单元,其中10个被认为是蛋白质编码),并分别源自回文P3和P1中b2和b4扩增子之间的NAHR。类似于AZFb缺失,AZFc完全缺失也可以基于NAHR事件的干预靶点(即b2/b4缺失)来参考。
AZFb和AZFc区域的异常重复增加了额外重排的发生,这些重排也可能与它们对精子发生的影响有关。一些对应于几乎全部去除AZFb和AZFc区域的缺失模式。这些AZFbc缺失是通过两种主要机制发生的,涉及P5/远端P1之间(7.7Mb,丢失42个转录单位)或P4/远端P1之间(7.0Mb,失去38个转录单位)的NAHR。此外,AZFc区域内较少的缺失(部分缺失)也会限制精子发生,这些是本指南重点。
综上所述,以下复发性Y染色体完全微缺失具有临床相关性,是无精子症或严重少精症男性生精障碍的原因(图2):
—AZFa
—AZFb(P5/近端P1)
—AZFc(b2/b4)
—AZFbc(P5/远端P1或P4/远端P1)
最常见的完全缺失类型是AZFc缺失(70%-80%),其次是AZFa缺失(0.5%-9%)、AZFb缺失(1%-7%)和AZFbc缺失(1%-20%)。AZFabc缺失最有可能与异常核型有关,如46,XX男性或iso(Y)。
四、AZF完全缺失的基因型-表型相关性
AZF缺失与生精失败特异性相关。尽管已经报道了一些罕见的AZFc完全缺失自然传播病例,但它们主要反映了这样一个事实,即在特殊条件下,精子数量非常低的男性可以进行自然受精。因此,将Y缺失视为无精子/少精子症的原因而不是“不育”的原因更为合适。AZF缺失检测具有预后价值,并可能影响治疗选择。应为所有符合TESE结合卵胞浆内单精子注射(TESE-ICSI)条件的无精子症患者提供缺失筛查。
AZFa区域完全缺失导致唯支持细胞综合征(SCO)睾丸表型和无精子症。AZFa区域完全缺失表明TESE-ICSI几乎不可能取到睾丸精子。
AZFb和AZFbc区域(P5/近端P1、P5/远端P1、P4/远端P1)完全缺失与无精子症有关,大约一半的男性具有SCO睾丸表型,另一半表现为生精性阻滞(通常具有正常的FSH和正常的睾丸体积),从而阻止男性配子的成功产生。与AZFa完全缺失类似,AZFb完全缺失的男性也几乎不可能通过TESE获得精子。然而,罕见的非典型AZFb或AZFbc缺失也可尝试利用TESE进行取精,这种缺失特征为P4回文的近端断点(而不是P5)。事实上,在P4处具有近端断点的较小缺失可能与额外的AZFb基因拷贝的保留有关,如XKRY、CDY2和HSFY,因此导致了TESE阳性结果的可能。同样,通过保留远端sY1192位点(扩展性缺失分析的一部分)确定的部分AZFb缺失也可以与残余精子兼容。强调区分完全(P5/近端P1)和部分AZFb缺失的重要性。考虑到以上情况,新版指南建议在强制扩展性缺失分析步骤中,确定AZFb缺失的远端断点时,将sY1192作为首选位点,而不是sY143。需要强调的是,不仅远端断点,近端断点也可以区分TESE阴性和TESE阳性患者。因此,执行扩展性缺失分析是最重要的,因为该信息将最终确定是否应该尝试TESE。只有完整的检测结果(包括基础和扩展性缺失位点)才能对AZFb缺失男性的生殖选择提供必要见解。在sY1192阴性P5/近端P1缺失的情况下,不建议使用TESE,因为提取到精子的机会非常低/几乎为零。然而,应该注意的是,可能由于遗传背景效应,sY1192阴性的AZFb和AZFbc缺失与完全精子发生相兼容的情况虽极为罕见,但也有发生。
AZFc完全缺失(b2/b4)与无精子症或严重少精子症有关,对精子发生有强烈的有害影响。但与AZFa和AZFb相反,AZFc完全缺失也有可能有残留精子发生。多项研究表明,与这种缺失类型相关的生精损伤表型会随着时间的推移而加重,但也有研究未能复现这种影响。AZFc完全缺失患者通过TESE获得精子的几率平均约为50%,但差异很大(从15%到71%),一方面是患者自身生物学上的差异,另一方面也说明了TESE技术方面的差异。根据现有数据,外周血中45%以上的X细胞系可被认为是精子发生的负面预测因素。
五、遗传咨询
5.1 遗传咨询
遗传咨询是强制性环节,以向患者提供有关妊娠精子发生受损男性后代风险的相关信息。
AZFc缺失以及AZFa和AZFb部分缺失,因为其可遗传性,需要对其男性家庭成员进行遗传咨询。
AZFa、AZFb和AZFabc的完全缺失通常没有精子产生,因此不建议进行家族筛查,也不应在报告中提及。
非终端AZFbc缺失通常与非参考Y染色体相关,在一些非典型缺失病例中,尽管生精功能严重受损,但仍可能有精子发生。这类缺失将强制性地传递给其男性后代,因此,患者应被告知妊娠精子发生受损男性后代的风险。
5.2 生殖策略
如果精液或睾丸中存在精子,AZF缺失患者可以自然受孕(在一些极罕见的AZFc完全缺失的病例中)或通过MAR受孕。AZFc完全缺失患者行ICSI的研究已有报道,个别研究发现缺失对关键MAR参数有负面影响,如受精率、胚胎质量和活产率下降,但大多数研究没有发现AZFc完全缺失与未缺失男性在受精率和妊娠率方面存在任何显著差异。因此,这种缺失是否对MAR结果有任何显著影响仍然是一个有争议的问题。近期一项基于12项研究的荟萃分析表明,与没有遗传异常的患者(使用精液精子或睾丸精子)相比,缺失患者除受精率显著下降外,其他生殖结果(如胚胎质量、临床妊娠率、流产率和活产率)都没有变化。
Y染色体微缺失的传播对后代健康的潜在影响是一个激烈争论的问题。虽然父亲的缺失必然会遗传给男性后代,从而导致子代精子发生受损,但由于不同的遗传背景和不同环境因素对生殖功能的影响,确切的睾丸表型无法预测。据报道,受Yq微缺失影响的父亲经ICSI所生婴儿的数量仍然相对较低,只有268例有充分记录。这些儿童中,除了一名在出生时患有肺动脉闭锁和右心室发育不全以及一名患有非特定“严重畸形”外,表型似乎都正常;而这两名儿童的父亲都携带AZFc缺失。人们对后代患特纳综合征(45,X)的潜在风险以及与性染色体嵌合体相关的其他表型异常(包括生殖器模糊)表示担忧。关于患有Y微缺失的男性和具有嵌合46,XY/45,X染色体核型和/或Turner患者数据表明,一些Yq微缺失可能与整体Y染色体不稳定有关,这可能导致45,X细胞系的形成。在268例报告的Yq缺失父亲所生的ICSI婴儿中,没有观察到生殖器模糊或特纳综合征。
两篇论文报道了对来自Y染色体缺失携带者的胚胎进行植入前遗传诊断,并提供了胚胎非整倍体率的数据。其中一项研究没有发现性染色体异常,而另一项研究发现了更高比例的X单体胚胎。建议在与患者讨论染色体异常的风险时要谨慎。此外,由于携带45,X染色体核型的胚胎有很高的自然流产风险,Yq缺失男性伴侣流产率可能更高。然而,这种可能性还有待正式检验。
没有证据表明AZFc完全缺失与后代的智力、心理或运动发育障碍有关。位于假常染色体区(PAR)的SHOX(矮小同源盒)基因的单倍体充足性的假定关联在更大的多中心研究中没有被复现,也没有在智利人群的独立研究中发现。后者仅在等臂染色体Yp和/或Y缺对相关的终端AZFbc缺失患者中发现了PAR异常。这项研究还报道了7名AZFbc终端缺失和核型异常患者中的5名出现神经障碍。值得注意的是,这一发现在更大的队列中的验证仍有待确定。
总之,Y染色体微缺失的分子诊断指征是基于严重生精量减少,强烈建议无精子症和严重少精症患者进行检测。然而,需要AZF缺失检测的严重少精症的阈值(1×106/mL至5×106/mL精子浓度范围内)仍存在争议(见上文)。AZF检测对精子提取具有预后价值,如果在精液或睾丸活检中发现精子,则缺失将传递给男性后代。虽然数据存在异质性,但最新荟萃分析表明,除受精率外,Y染色体重排不会显著影响MAR结果。尽管在过去10年间,父亲Y染色体缺失所生婴儿的数量进一步增加,但仍然没有关于特纳综合征、生殖器模糊或其他染色体异常的确切风险的明确信息。显然,有必要针对Yq缺失的男性及其潜在后代制定强有力的后续计划。AZFc完全缺失和AZFb或AZFa部分缺失时,应在实验室报告中要求对该家族的男性成员进行分析。此外,AZFc完全缺失或Yq终端缺失时,建议进行广泛的核型分析(计数100个中期),以排除与结构异常的Y染色体相关的46,XY/45,X嵌合体。
六、AZF部分缺失
6.1 AZFa区域基因特异性缺失
尽管一些研究发现单个AZF基因缺失的发生频率非常高,但这些数据与一项包含2000多名患者的大样本研究结果大相径庭。所有已确认的AZF基因特异性缺失(具有明确的断点)均位于AZFa区,其中5个特异性缺失部分或完全影响USP9Y基因。基因特异性缺失均不是由NAHR引起的,其特异性导致此类事件极为罕见,而且AZFa部分缺失的相关表型异质性很大,从无精子症到正常精子症都可能发生,提示USP9Y是精子发生过程中的精细调节因子,而并不是决定性因子。此外,DDX3Y的功能缺失变异是无精子症的病因,该基因也是AZFa区域的关键生精因子。
6.2 AZFc部分缺失——gr/gr缺失及其临床意义
AZFc区域特别容易受到NAHR事件的影响,从而可能导致部分缺失和重复。其中,gr/gr缺失是被研究得较为广泛的一种,该缺失可以造成AZFc区域近一半的基因丢失(具有生殖细胞独有或显性表达的基因)。gr/gr缺失的表型高度可变,从无精症到正常精子量表现不一,对生精的影响依然存在争议。且该缺失表型具有群体依赖性以及可能是TGCT的诱发因素,并可能在子代中扩展为AZFc区的完全缺失。因此,gr/gr缺失是精子生成障碍遗传分析风险因素的一个特例,其是否作为常规检测尚未达成共识,需由诊断实验室和送检临床医生自行决定。
6.3 诊断指南
检测AZF缺失的首选方法是对Y染色体的选定区域进行PCR扩增。已有研究表明,与定位于非编码区的有效位点相比,使用基因特异性序列位点(STS)并没有提高临床相关微缺失的检测率。因此,从临床角度来看,所选位点是扩增匿名区域还是扩增特定的MSY基因基本上并不重要。真正至关重要的是,所选择位点能够显示出一致的微缺失模式。
6.3.1 AZFa缺失检测
AZFa区域的分子检测使用两个STS标记:sY84和sY86。两者都位于USP9Y和DDX3Y基因上游。根据缺失的致病机制和现有数据,sY84和sY86同时缺失时,并不是100%的AZFa完全缺失,但其概率是非常高的,有可能(尽管很少)两个位点都缺失而不影响AZFa的两个基因,或只有USP9Y基因受到影响。因此,AZFa缺失检测需要进行强制性的扩展性缺失分析,包括近端边界sY82(present)/sY1064(absent)以及远端边界sY1065或sY1182(absent)/sY88(present)。近期数据表明,相当一部分AZFa完全缺失病例中,近端断点标记sY83(既往版本作为sY1064的等效选项)仍然存在。因此,为了避免将AZFa完全缺失误诊为部分缺失,强烈建议在扩展性缺失分析中使用sY1064而不是sY83(或者至少应该检测sY1064,以证实在sY83阳性病例中确实是完全缺失)。这两个AZFa基因位于AZFa区域更远端,因此检测推荐远端AZFa位点与TESE预后非常相关,且近端断点的确切位置(sY83存在或不存在)实际上并不影响对缺失的临床解释。如果只发现sY84或sY86缺失(排除扩增失败),则应对AZFa区域进行更详细的研究。然而,这一事件目前被认为是非常罕见的。
6.3.2 AZFb缺失检测
sY127和sY134分别位于AZFb区域的中端和远端。根据现有数据,绝大多数情况下,两个位点缺失即可表明AZFb区域完全缺失。但为了明确TESE的预后,需要使用额外位点进行强制扩展性缺失分析,所选用位点包括:近端边界的sY105(present)、sY121/sY1224(absent),以及远端边界的sY1192(absent)和sY153(present)。需要注意的是,以前版本认为sY143或sY1192是可以等效的,但最近数据表明,sY1192(而不是sY143)对TESE预后有价值。此外,近期数据还表明,以前版本中推荐的sY1224(相当于sY121)在相当数量的AZFb和AZFbc完全缺失患者中仍然存在。尽管这种变异的表型仍有待表征,但强烈鼓励使用位点sY121和sY1224(当sY121不存在时)。再次重申之前的建议,即反对检测位点sY114和sY152(仍包含在一些商业试剂盒中),因为它们定位于染色体上多个基因组区域中。特别地,sY152定位于DAZ基因,类似于sY255和sY254。在这方面,再次强调,根据sY152的假设缺失定义的所谓“AZFd”区域并不存在。尽管一些商业试剂盒仍然包含这个假定区域,但强烈建议不要使用此类产品。
6.3.3 AZFc缺失检测
位点sY254和sY255是DAZ基因的特异性标记位点,DAZ基因在Y染色体序列中以四个拷贝的形式存在,排列在两个簇中。当sY254和sY255同时缺失时,即可诊断AZFc区完全缺失。基于现有数据表明,这两个位点中单一位点的缺失是极不可能的,提示方法学错误。强制扩展性缺失分析使用异染色质位点sY160区分完全AZFc缺失(b2/b4缺失模式,sY160存在)和终端缺失(sY1160缺失)。终端缺失以及b2/b4缺失可能与嵌合核型(46,XY/45,X)有关,因此,出于TESE预后原因,也应要求进行核型分析。
如果实验室决定检测gr/gr部分AZFc缺失,可以通过使用两个位点来实现:sY1291和sY1191;位点sY1291缺失和sY1191存在即可进行判断。值得注意的是,一项多中心研究中检测到5%的假缺失率,强调了优化PCR条件和额外验证步骤的重要性。建议对亚洲患者进行Y单倍群分析,以排除不太可能影响精子发生的Y谱系固定缺失。
6.3.4 检测AZFbc缺失
sY127、sY134、sY254和sY255四个位点全部缺失提示AZFb和AZFc区域均完全缺失。更特异性的位点sY116可以用于确定AZFbc的缺失模式,如P4/P1远端缺失,sY116存在,或P5/P1远端缺失时sY116也缺失,该定义具有临床预后价值。强烈建议AZFbc缺失时进行异染色质位点sY160检测,以确定是否存在终端缺失。
6.4 PCR反应体系的建立:内部质量控制和推荐位点
临床诊断中,基因组DNA的PCR扩增需要严格遵守良好的实验室规范和质量控制的基本原则,检测时必须平行检测阳性和阴性对照。AZF缺失检测时,应同步检测阳性和阴性对照,即一个精子发生正常的男性样本和一个女性样本。此外,需加入空白对照——水样(只是用水代替模板DNA,包含除模版DNA外所有成分的PCR反应)。每一组PCR反应都至少采用两管或更好的多重PCR进行。SRY基因是男性性别决定基因,位于Y染色体短臂,作为内对照,SRY基因可以在ZFY基因丢失时证明Y染色体特征序列的存在(比如:在XX男性中)。AZF诊断中另一个重要内对照是ZFX/ZFY基因,ZFX/ZFY检测不仅与女性对照DNA相关,而且与SRY阴性的46,XX男性相关,是唯一的阳性标记。
原则上,在每个AZF区域中仅分析一个非多态性STS位点,就足以确定AZFa、AZFb或AZFc中是否存在缺失。然而,任何一个已知缺失区域都包括多个STS位点,分析每个区域中的2个STS位点可以提高诊断的准确性。因此,在检测的第一步(基础检测分析)中,每个AZF区域中至少应分析2个STS位点。基于众多实验室经验,外部质量控制结果,并考虑到多重PCR扩增的形式,以前版本指南中推荐的STS引物的首选仍然有效。这些引物包括:
AZFa:sY84*;sY86
AZFb:sY127;sY134
AZFc:sY254,sY255(均在DAZ基因中)
*更新了sY84-F和sY84-R的序列。根据最新测序数据,sY84-F引物序列中间位置存在错配,新指南对引物序列进行了修正。关于sY84-R,在亚洲人群中检测到引物序列第5核苷酸位置存在一个基因多态性SNP(rs72609647)。因此,如果该来源的样本扩增失败,应检测sY84的替代引物和/或sY84的替代邻近位点。
对于强制扩展性缺失分析,推荐的引物为:
AZFa:近端断点:sY82和sY1064;远端断点:sY1065(或sY1182)和sY88
AZFb:近端断点:sY105和sY121/sY1224;远端断点:sY1192和sY153
AZ1Fc:sY160
总之,这两种引物组的使用足以用于常规诊断,能够检测几乎所有临床相关的AZF缺失以及文献中报道的95%以上的缺失,同时为TESE提供足够的预后价值。强烈鼓励所有实验室采用这些位点,便于实验室质量控制,并将检测差异降至最低。
6.5 检测结果及重复检测结果解释
指南建议的方案都经过认真设计和优化,采用两管多重PCR反应,每管多重PCR反应体系中都包括每个区域的一个位点。因此,当样本中发生完全缺失时,两管PCR反应都应显示该区域特异性位点缺失。虽然如果相关区域仅一个位点缺失,AZFa和AZFb区域的部分缺失是可能的,但仅sY254或sY255(AZFc/DAZ)的选择性单个位点缺失通常被视为方法学错误。如果只有一个AZFa或AZFb位点缺失,则首先必须仔细求证该缺失情况,然后对整个区域进行更详细的研究。如果AZFabc缺失(所有8个Yq位点都缺失),则对照位点(SRY和ZFX/ZFY)的解释非常重要,以排除技术问题。
每个实验室应根据可用的设备和试剂(如PCR仪和DNA聚合酶的类型)以及DNA质量/数量/来源,仔细优化PCR反应条件。如果结果不明确和/或怀疑存在技术故障,则应重复进行多重反应。如果多重反应对特定的DNA样本不起作用,则可以在单管反应中运行引物组。如果两个多重PCR的结果一致支持缺失,则该缺失被确认。如果两个多重PCR检测的结果不一致,则应在单管PCR中重复整套引物。单管PCR不易发生扩增失败,强烈建议在较低的退火温度下重复反应。为避免扩增失败,应极力避免相同引物的重复冻融。关于反应重复次数,没有一般性建议,应直到结果清晰和可重复(良好的实验室建议)。
七、遗传学检测结果报告
报告应以标准化格式编写,并应对非专业人员清晰友好。一般来说,报告必须清楚、简明、准确和易于解释,不可以接受手写的报告。报告必须包括以下一般信息:
送检患者的医生身份
检测和出具报告实验室的清晰和完整的身份识别(包括唯一的实验室编号/识别号码)
标题
送检和报告日期
患者信息:完整姓名、姓氏、出生日期和生理性别
样本类型(如血液、口腔涂片等)
非专业人员可以理解的书面解释和结论
(至少)两名独立评估人员的签名(包括他们的职责)
页码
如果报告超过一页,页码应该清晰(如第X页/共Y页),每页都应有患者身份标识
还必须包括以下具体信息:
以某种形式重述送检的原因(如,对Y染色体微缺失的诊断)和适应症(如,无精子症、ICSI准备、pre-TESE等)。
所用方法(如多重PCR扩增),包括检测方法的局限性;如果使用了市售的试剂盒,则必须披露其名称、制造商和批号。
如果检测/分析外包给外部实验室或公司,必须清楚地说明这些信息。
分析结果:必须报告被检测位点的结果。最好利用表格列出所有支持解释的STS位点结果(注意:如果使用了包含大量位点的试剂盒,建议在报告中只列出与解释相关的位点结果)。避免使用+和-,这可能会造成误解,用单词代替(例如,present/absent,或类似的)。
7.1 Y微缺失检测的替代方法
自1999年第一份指南发表以来,已经开发了多种评估Y染色体缺失的替代方法。此外,还提供了各种商业试剂盒。然而,这些往往包含不必要的大量位点,并由此混淆分析,最终导致“假性”缺失的诊断结果,尤其是在DNA质量和/或PCR条件不理想的情况下。此外,大多数试剂盒不能通过单管PCR对疑似缺失进行验证。基于基因特异性位点的多重PCR方法允许检测孤立的基因特异性缺失,但这些缺失的临床意义极端罕见和不明确,阻碍了其在常规诊断中的应用。此外,这些试剂盒中包含基因特异性位点,需对结果进行特别仔细的解释,并在可能的情况下验证可疑的单基因缺失。
已公布的替代方法,部分基于指南,部分则没有,主要包括毛细管电泳、real-time PCR、MLPA、aCGH或下一代测序(NGS)。real-time PCR的优点是相对快速,不涉及凝胶电泳,但所需的设备比标准方法更不容易获得。AZF区域的特殊结构及其在不同人群中的显著差异对广泛实施基于NGS的方法提出了重大挑战。这些挑战可能导致诊断错误,并强烈建议在没有适当验证和Y染色体分析的广泛专业知识的诊断条件下考虑使用基于NGS的方法时要谨慎。随着这项技术的可用性和正确实施变得越来越普遍,它可能会带来新的、更全面的检测,从而进一步提高无精子症男性的诊断率。
总之,在以前版本的指南中建立的两步多重PCR仍然是进行Y染色体缺失检测的最具成本效益、可重复性和最容易获得的方法。如果实验室决定建立替代方法,则需要在适当数量的样本上验证新方法,包括阳性和阴性对照,以评估检测的特异性和敏感性。无论何时采用替代方法,报告都应明确包括所使用的确切实验设计,而不是将其称为“根据指南”。后者仅适用于本文所述的两步多重PCR+强制扩展性缺失分析。
八、EAA/EMQN外部质量评估22年经验
强烈建议进行AZF检测的实验室加入年度“EQA计划”。该计划每年向参与实验室分发三份具有模拟临床病例特征的、经验证的DNA样本,处理方式与患者样本的处理方法完全相同,包括报告。实验室结果由至少两名独立评审员进行评估。从2000年至2012年,参与该计划的实验室数量几乎增加了两倍,从57个增加到148个(图3A),这一数字在过去10年中一直保持稳定。诊断错误率也急剧下降,从该项目开始前5年的近8%下降到目前的1%-2%(图3B)。参与评估的诊断报告质量和结果解释显著提高,在过去4年中,超过70%的分析报告获得满分。值得注意的是,不必要的大量位点检测——通常是商用试剂盒的一部分——仍然是解释错误的主要来源。总之,这一既定的EAA/EMQN AZF方案已经证明,它是提高参与实验室绩效的一个有价值的工具,建议进行AZF检测的实验室都加入该年度计划。
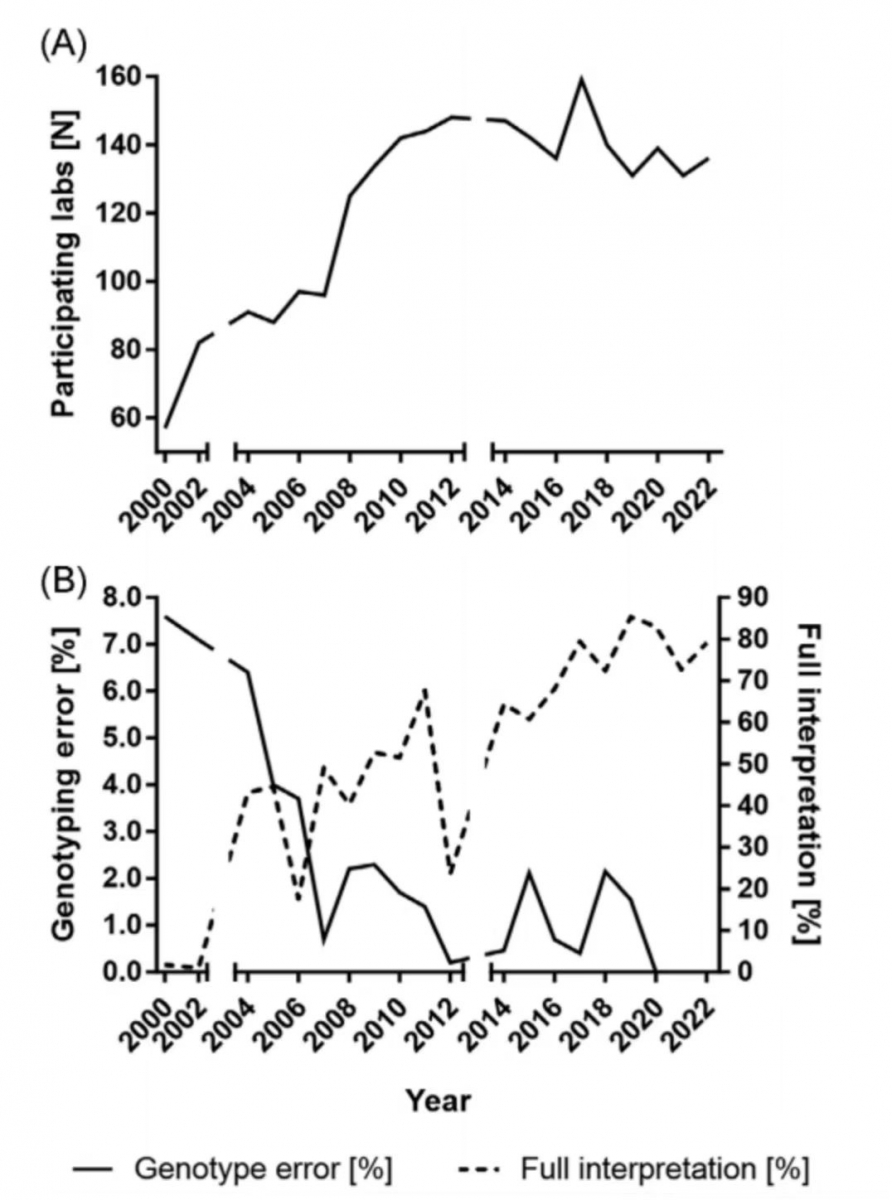
图3 EAA/EMQN外部质量控制方案在评估实验室绩效方面的22年经验结果
参考文献:
[1] Krausz C, Navarro-Costa P, Wilke M, Tüttelmann F. EAA/EMQN best practice guidelines for molecular diagnosis of Y-chromosomal microdeletions: State of the art 2023. Andrology. 2023;1-18. https://doi.org/10.1111/andr.13514


与生殖相关信息



 京公网安备 11011502004210号
京公网安备 11011502004210号